Учебник по Физике.
Оглавление учебника
Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа. Основное уравнение молекулярно-кинетической теории газа с учетом определения абсолютной температуры принимает вид:Пусть масса рассматриваемого газа в объеме V равна m, а масса отдельной молекулы m0. Тогда
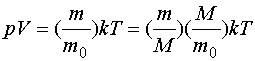
где M - молярная масса. По определению m/M = n, а M/m0 = NA. Поэтому
где введена универсальная газовая постоянная
R = kNA = 8,31 Дж/(моль·К).
Итак, справедливо уравнение состояния, связывающее давление, объем и температуру идеального газа:
Из этого уравнения следует, что параметры двух произвольных состояний 1 и 2 идеального газа связаны между собой:
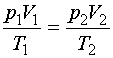 (4.1)
(4.1)Диаграммы состояния. Если переход между состояниями системы с разными значениями p, V, T (для определенности можно все время иметь в виду состояние идеального газа) происходит так медленно, что в каждый данный момент времени систему можно считать находящейся в равновесии с окружающей средой, то такой переход называется квазистатическим. Удобно изображать квазистатические процессы на pV-диаграмме. Каждой точке этой диаграммы отвечает определенное состояние системы с данными значениями p, V, T. Квазистатический процесс перехода из одного состояния в другое изображается непрерывной линией на pV-диаграмме.
- Газовые законы
- При постоянной температуре T = const (изотермический процесс) pV = const. (закон Р. Бойля и Э. Мариотта).
- При постоянном давлении р = const (изобарический процесс) V/T = const. (закон Ж. Гей-Люссака).
- При постоянном объеме V = const (изохорический процесс) p/T = const. (закон Ж. Шарля).
- Процесс, происходящий в теплоизолированной системе (адиабатический процесс) pVg = const.