Учебник по Химии.
Оглавление учебника
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
5. Химическая связь
Согласно теории химической связи, наибольшей устойчивостью обладают внешние оболочки из двух или восьми электронов (электронные группировки благородных газов). Атомы, имеющие на внешней оболочке менее восьми (или иногда двух) электронов, стремятся приобрести структуру благородных газов. Такая закономерность позволила В. Косселю и Г. Льюису сформулировать положение, которое является основным при рассмотрении условий образования молекулы: “При образовании молекулы в ходе химической реакции атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки”.
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводить к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи. Таковы ионная, ковалентная и донорно-акцепторная (координационная) связи. Кроме этих видов связей существуют другие, не относящиеся непосредственно к электронным оболочкам. Таковы водородная и металлическая связи.
Валентность элементов в соединениях.
Современные представления о природе химической связи основаны на электронной (спиновой) теории валентности (наибольший вклад в развитие этой теории внесли Г. Льюис и В. Коссель), в соответствии с которой атомы, образуя связи, стремятся к достижению наиболее устойчивой (т. е. имеющей наименьшую энергию) электронной конфигурации. При этом электроны, принимающие участие в образовании химических связей, называются валентными.Согласно спиновой теории, валентность атома определяется числом его неспаренных электронов, способных участвовать в образовании химических связей с другими атомами, поэтому валентность всегда выражается небольшими целыми числами.
Рассмотрим электронную конфигурацию атома углерода. В свободном состоянии он имеет два неспаренных электрона и два спаренных электрона в состоянии 2s. В определенных условиях (при затрате некоторого количества энергии извне) эту пару электронов 2s2 можно разъединить (“распарить”) путем перевода одного электрона из состояния 2s в состояние 2р и сделать эти электроны также валентными:
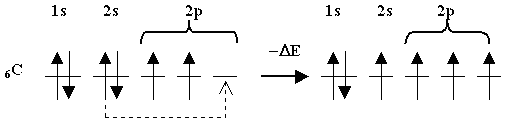
В таком состоянии атом углерода может образовывать соединения, где он будет четырехвалентен.
Процесс распаривания электронов требует определенной затраты энергии (D E), и, казалось бы, он не выгоден. Но для учета энергетических соотношений нужно рассмотреть весь баланс образования связей. Дело в том, что при переходе одного из электронов 2s в состояние 2р получается состояние атома, в котором он может образовать уже не две, а четыре связи. При образовании химической связи обычно выделяется энергия, поэтому появление двух новых валентностей приводит к выделению дополнительной энергии, которая превосходит энергию D E затраченную на распаривание 2s-электронов.
Опыты доказали, что энергия, затраченная на распаривание электронов в пределах одного энергетического уровня, как правило, полностью компенсируется энергией, выделенной при образовании дополнительных связей.
Чтобы таким же образом получить, например, четырехвалентный кислород, трехвалентный литий, двухвалентный неон, необходима очень большая затрата энергии
D E связанная с переходом 2р ® 3s (кислород). 1s ® 2р (литий), 2р ® 3s (неон). В этом случае затрата энергии настолько велика, что не может быть компенсирована энергией, выделяющейся при образовании химических связей. Поэтому и не существует соединений с переменной валентностью кислорода, лития или неона.Подтверждением этого положения могут служить достижения в химии благородных (инертных) газов. Долго считалось, что инертные газы не образуют химических соединений (отсюда и
их название). Однако в 1962 г. химикам удалось получить несколько соединений “инертных” газов, например, XeF2, XeF4, ХеО3. Проявление инертными газами определенной валентности можно объяснить, только допустив, что спаренные электроны полностью заполненных подуровней могут распариваться в пределах уровня.Энергия связи. Существенной характеристикой химической связи является ее прочность. Для оценки прочности связей обычно пользуются понятием энергии связей.
Энергия связи — это работа, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества.
Чаще всего энергию связи измеряют в кДж/моль. Наиболее прочными являются ионные и ковалентные связи, энергии этих связей составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. Об этом свидетельствуют, в частности, высокие температуры кипения металлов, например 357 °С (Hg), 880 °С (Na), 3000 ° С (Fe) и т. д. Энергии водородных связей очень небольшие по сравнению с энергией межатомных связей. Так, энергия водородной связи составляет обычно величину 20—40 кДж/моль, тогда как энергия ковалентных связей может достигать несколько сотен кДж/моль.Ионная связь.
Ионная связь — это электростатическое взаимодействие между ионами с зарядами противоположного знака.Коссель предположил, что ионная связь образуется в результате полного переноса одного или нескольких электронов от одного атома к другому. Такой тип связи возможен только между атомами, которые резко отличаются по свойствам. Например, элементы I и II групп периодической системы (типичные металлы) непосредственно соединяются с элементами VI и VII групп (типичными неметаллами). В качестве примеров веществ с ионной связью можно назвать MgS, NaCl, А2O3. Такие вещества при обычных условиях являются твердыми, имеют высокие температуры плавления и кипения, их расплавы и растворы проводят электрический ток.
Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления, которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении.
Использование понятия степени окисления для атомов элементов, образующих другие виды химической связи, не всегда корректно и требует большой осторожности.
Ковалентная связь. Известно, что неметаллы взаимодействуют друг с другом. Рассмотрим образование простейшей молекулы Н2.
Представим себе, что мы имеем два отдельных изолированных атома водорода Н' и Н". При сближении этих атомов между собой силы электростатического взаимодействия — силы притяжения электрона атома Н' к ядру атома Н" и электрона атома Н" к ядру атома Н' — будут возрастать: атомы начнут притягиваться друг к другу. Однако одновременно будут возрастать и силы отталкивания между одноименно заряженными ядрами атомов и между
электронами этих атомов. Это приведет к тому, что атомы смогут сблизиться между собой настолько, что силы притяжения будут полностью уравновешены силами отталкивания. Расчет этого расстояния (длины ковалентной связи) показывает, что атомы сблизятся настолько, что электронные оболочки, участвующие в образовании связи, начнут перекрываться между собой. Это, в свою очередь, приведет к тому, что электрон, двигавшийся ранее в поле притяжения только одного ядра, получит возможность перемещаться и в поле притяжения другого ядра. Таким образом, в какой-то момент времени то вокруг одного, то вокруг другого атома будет возникать заполненная оболочка благородного газа (такой процесс может происходить только с электронами, обладающими противоположно направленными проекциями спина). При этом возникает общая пара электронов, одновременно принадлежащая обоим атомам.Область перекрытия между электронными оболочками имеет повышенную электронную плотность, которая уменьшает отталкивание между ядрами и способствует образованию ковалентной связи.
Таким образом, связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Полярность связи. Ковалентная связь может возникать не только между одинаковыми, но и между разными атомами. Так, образование молекулы НСl из атомов водорода и хлора происходит также за счет общей пары электронов, однако эта пара в большей мере принадлежит атому хлора, нежели атому водорода, поскольку неметаллические свойства у хлора выражены гораздо сильнее, чем у водорода.
Разновидность ковалентной связи, образованной одинаковыми атомами, называют неполярной, а образованной разными атомами — полярной.
Полярность связи количественно оценивается дипольным моментом
m , который является произведением длины диполя l — расстояния между двумя равными по величине и противоположными по знаку зарядами +q и -q — на абсолютную величину заряда:m
= lЧ q.Дипольный момент является величиной векторной и направлен по оси диполя от отрицательного заряда к положительному. Следует различать дипольные моменты (полярность) связи и молекулы в целом. Так, для простейших двухатомных молекул дипольный момент связи равен дипольному моменту молекулы.
Напротив, в молекуле оксида углерода (IV) каждая из связей полярна, а молекула в целом неполярна (
m =0), так как молекула О==С==О линейна, и дипольные моменты связей С==О компенсируют друг друга (см. рис.). Наличие дипольного момента в молекуле воды означает, что она нелинейна, т. е. связи О—Н расположены под углом, не равным 180° (см. рис.).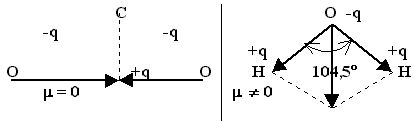
Электроотрицательность. Наряду с дипольными моментами для оценки степени ионности (полярности) связи используют и другую распространенную характеристику, называемую электроотрицательностью.
Электроотрицательность — это способность атома притягивать к себе валентные электроны других атомов. Электроотрицательность (ЭО) не может быть измерена и выражена в единицах каких-либо физических величин, поэтому для количественного определения ЭО предложены несколько шкал, наибольшее признание и распространение из которых получила шкала относительных ЭО, разработанная Л. Полингом.
По шкале Полинга ЭО фтора (наиболее электроотрицательного из всех элементов) условно принята равной
4,0;на втором месте находится кислород, на третьем — азот и хлор. Водород и типичные неметаллы находятся в центре шкалы; значения их ЭО близки к 2. Большинство металлов имеют значения ЭО, приблизительно равные 1,7 или меньше. ЭО является безразмерной величиной.Шкала ЭО Полинга в общих чертах напоминает периодическую систему элементов. Эта шкала позволяет дать оценку степени ионностй (полярности) связи. Для этого используют зависимость между разностью ЭО и степенью ионности связи.
Чем больше разность ЭО, тем больше степень ионности. Разность ЭО, равная 1,7, соответствует 50%-ному ионному характеру связей, поэтому связи с разностью ЭО больше 1,7 могут считаться ионными, связи с меньшей разностью относят к ковалентным полярным.
Энергия ионизации. Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации.
Сродство к электрону. Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода.
Степень окисления в ковалентных соединениях. Для полярных соединений также часто используют понятие степени окисления, условно считая, что такие соединения состоят только из ионов. Так, в галогеноводородах и воде водород имеет формально положительную валентность, равную 1+, галогены — формально отрицательную валентность 1-, кислород — отрицательную валентность 2-: H
+F- , H+Cl- , H2+O2- .Понятие степени окисления было введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение).
Поэтому в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.Совсем формальным понятие “степень окисления” становится, когда оно используется при рассмотрении ковалентного соединения, поскольку степень окисления — это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Ясно, что в действительности никаких ионов в ковалентных соединениях нет.
Различие между понятием степени окисления и валентности в ковалентных соединениях особенно наглядно можно проиллюстрировать на хлорпроизводных соединениях метана: валентность углерода везде равна четырем, а степень окисления его (считая степени окисления водорода 1+ и хлора 1- во всех соединениях) в каждом соединении разная: 4- СH4, 2- CH3Cl, 0CH2Cl2, 2+CHCl3, 4+CCl4.
Таким образом, нужно помнить, что степень окисления — условное, формальное понятие и, чаще всего не характеризует реальное валентное состояние атома в молекуле.
Донорно-акцепторная связь. Помимо механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый до-норно-акцепторный механизм. Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (звездочками обозначены электроны внешнего уровня атома азота):
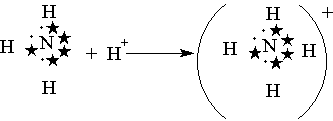
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н—N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. все связи равноценны, независимо от механизма их образования. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s- и 2р-электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали (здесь осуществляется sp3-гибридизация).
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н
+ в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н2О и иона Н+ всегда образуется ион гидро-ксония Н3О+ Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H+.Донорно-акцепторный механизм образования связи помогает понять причину амфотерности гидроксида алюминия: в молекулах Аl(ОН)3 вокруг атома алюминия имеется 6 электронов — незаполненная электронная оболочка. Для завершения этой оболочки не хватает двух электронов. И когда к гидроксиду алюминия прибавляют раствор щелочи, содержащей большое количество гидроксильных ионов, каждый из которых имеет отрицательный заряд и три неподеленные пары электронов (ОН)- , то ионы гидроксида атакуют атом алюминия и образуют ион [Аl(ОН)4]- , который имеет отрицательный заряд (переданный ему гидроксид-ионом) и полностью завершенную восьмиэлектронную оболочку вокруг атома алюминия.
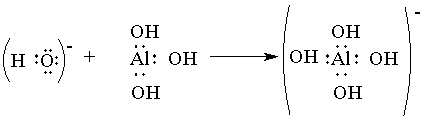
Аналогично происходит образование связей и во многих других молекулах, даже в таких “простых”, как молекула НNО3:
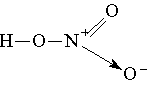
Атом азота при этом отдает свою электронную пару атому кислорода, который ее принимает: в результате как вокруг атома кислорода, так и вокруг азота достигается полностью завершенная восьмиэлектронная оболочка, но поскольку атом азота отдал свою пару и поэтому владеет ею совместно с другим атомом, он приобрел заряд “+”, а атом кислорода — заряд “-”. Cтепень окисления азота в HNO3 равна 5+, тогда как валентность равна 4.
Пространственное строение молекул. Представления о природе ковалентных связей с учетом типа орбиталей, участвующих в образовании химической связи, позволяют делать некоторые суждения о форме молекул.
Если химическая связь образуется с помощью электронов s-орбиталей, как, например, в молекуле Н2, то в силу сферической формы s-орбиталей не существует никакого преимущественного направления в пространстве для наиболее выгодного образования связей. Электронная плотность в случае р-орбиталей распределена в пространстве неравномерно, поэтому появляется некоторое выделенное направление, вдоль которого наиболее вероятно образование ковалентной связи.
Рассмотрим примеры, которые позволяют понять общие закономерности в направленности химических связей. Обсудим образование связей в молекуле воды H2O. Молекула H2O образуется из атома кислорода и двух атомов водорода. Атом кислорода имеет два неспаренных электрона, которые занимают две орбитали, расположенные под углом 90° друг к другу. Атомы водорода имеют неспаренные 1s-электроны. Ясно, что углы между двумя связями О—Н, образованными р-электронами атома кислорода с s-электронами атомов водорода, должны быть прямыми или близкими к нему (см. рис.).
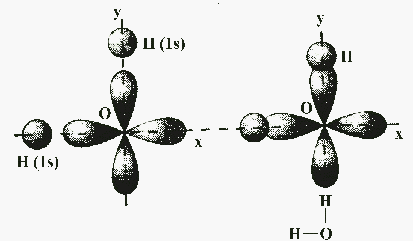
Аналогично, прямыми должны быть углы между связями в молекулах Н
2О, H2S, F2О. Cl2O, РН3, РСl3 и т. д. Действительные значения углов между связями заметно отличаются от теоретических.Увеличение валентных углов (> 90°) вполне объяснимо взаимным отталкиванием не связанных друг с другом атомов, которое мы не учитывали при предсказании углов между связями. Так, взаимное отталкивание атомов водорода в молекуле H
2S слабее, чем в молекуле Н2О (так как радиус атома серы больше радиуса атома кислорода), поэтому и валентные углы Н—S—Н ближе к 90°, чем углы Н—О—Н.Таким образом, двухвалентный атом неметалла с двумя валентными р-орбиталями образует изогнутую (угловую, с углом, близким к 90°) молекулу, а трехвалентный атом с тремя валентными р-орбиталями образует молекулу, имеющую форму пирамиды.
Гибридизация орбиталей. Рассмотрим образование молекулы метана СН
4. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами — ls22sl2p3.Рассуждая как в случае H
2O, можно было бы предполагать, что атом углерода будет образовывать три связи С—Н, направленные под прямым углом друг к другу (р-электроны), и одну связь, образованную s-электроном, направление которой было бы произвольным, поскольку s-орбиталь имеет сферическую симметрию.Следовательно, можно было ожидать, что три связи С—Н в СН
4 являются направленными p-связями и совершенно одинаковы, а четвертая связь есть ненаправленная s—s-связь и отличается от первых трех.Однако экспериментальные данные показали, что все четыре связи С—Н в молекуле метана СН
4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109,5°).Ввиду относительной близости значений энергии 2s- и 2p-электронов эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Четыре sp
3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу, они направлены к вершинам тетраэдра, в центре которого находится атом углерода. Гибридная орбиталь сильно вытянута в одну сторону от ядра (см. рис.).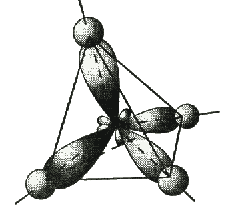
Это обусловливает более сильное перекрывание таких орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием s- и р-орбиталей и приводит к образованию более прочных связей.
Таким образом, при образовании молекулы метана различные орбитали валентных электронов атома углерода — одна s-орбиталь и три р-орбитали — превращаются в четыре одинаковые “гибридные” sр
3-орбитали (sp3-гибридизация). Этим и объясняется равноценность четырех связей атома углерода в молекуле.Гибридизация оказывается характерной не только для соединений атома углерода. Гибридизация орбиталей может происходить в том случае, когда в образовании связей одновременно участвуют электроны, которые принадлежат к различным типам орбиталей.
Рассмотрим примеры различных видов гибридизации s
- и р-орбиталей. Гибридизация одной s- и одной р-орбиталей (sp-гибридизация) происходит при образовании галогенидов бериллия, например BeF2, цинка, ртути, молекулы ацетилена и др. Атомы этих элементов в основном состоянии имеют на внешнем слое два спаренных s-электрона. В результате возбуждения один из электронов s-орбитали переходит на близкую по энергии р-орбиталь, т. е. появляются два неспаренных электрона, один из которых s-электрон, а другой р-электрон. При возникновении химической связи эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации — sp), направленные под углом 180° друг к другу, т. е. эти две связи имеют противоположное направление (см. рис.).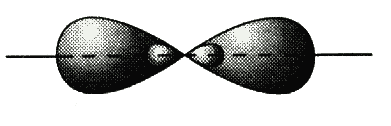
Экспериментальное определение структуры молекул BeX
2, ZnX2, HgX2, C2H2 и т. д. (X — галоген) показало, что эти молекулы действительно являются линейными.Остановимся подробнее на структуре молекулы ацетилена С
2Н2. В молекуле ацетилена каждый атом углерода образует две гибридизированные связи, направленные под углом 180° друг к другу (см. рис.).Как при образовании связей
С—С, так и при образовании связей С—Н возникает общее двухэлектронное облако, образуя s -связи. В общем случае s -связью можно назвать связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена атомы углерода находятся в sp-гибридных состояниях, т. е. в каждом из атомов углерода содержится еще по два р-электрона, которые не принимали участие в образовании
s -связей. Молекула ацетилена имеет плоский линейный скелет, поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. В этом случае происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании s -связей. Таким образом, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые p -связями (см. рис.).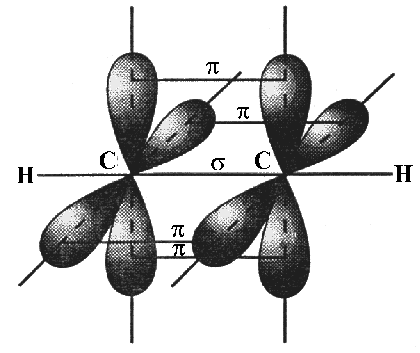
Случай образования кратных связей
между атомами углерода для молекулы ацетилена — случай образования тройной связи, которая состоит из одной s - и двух p -связей. s -Связи являются более прочными, чем p -связи.Еще один вид гибридизации s- и p-орбиталей осуществляется, например, в соединениях бора, алюминия или углерода (этилен бензол). Возбужденный атом бора имеет один s- и два p-электрона. В этом случае при образовании соединений бора происходит гибридизация одной s- и двух p-орбиталей (ps2-гибридизация), при этом образуется три одинаковые sp2–гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу (см. рис.).
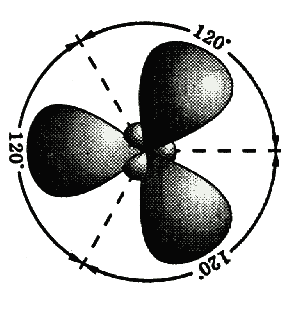
Эксперименты показали, что такие соединения как BF
3, AlCl3, а также этилен и бензол имеют плоское строение и все три связи Bѕ F(в молекуле BF3) расположены под углом 120° друг к другу.Посредством образования sp
2-гибридных орбиталей объясняются и структуры непредельных углеводородов.Водородная связь. Само название этого типа связи подчеркивает, что в ее образовании принимает участие атом водорода. Водородные связи могут образовываться в тех случаях, когда атом водорода связан с электроотрицательным атомом, который смещает на себя электронное облако, создавая тем самым положительный заряд
d + на водороде.Водородная связь, как и другие рассмотренные нами типы связей, обусловлена электростатическим взаимодействием, но это взаимодействие осуществляется уже не между атомами, а между молекулами. Таким образом, водородная связь — пример межмолекулярной связи.
В качестве примера рассмотрим образование водородной связи между двумя молекулами воды. Связи О—Н в Н2О имеют заметный полярный характер с избытком отрицательного заряда d - на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд d + и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды.
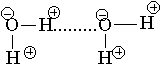
Водородная связь обычно схематично изображается точками.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H2O)2, (Н2O)3 и т. д. В растворах же могут возникать длинные цепи ассоциатов такого вида:
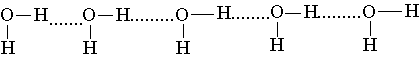
поскольку атом кислорода имеет две неподеленные пары электронов.
Таким образом, водородные связи могут образовываться, если есть полярная Х—Н связь и свободная пара электронов. Например, молекулы органических соединений, содержащие группы —ОН, —СООН, —CONH2, —NH2 и др., часто ассоциированы вследствие! образования водородных связей.
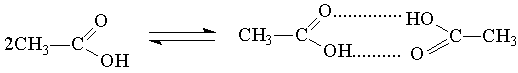 Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусycной кислоты, измеренная по плотности пара, оказывается удвоенной (120 вместо 60).
Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусycной кислоты, измеренная по плотности пара, оказывается удвоенной (120 вместо 60).
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. По-видимому, наиболее важным и, несомненно, одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями.
Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других простых или сложных веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи — металлической связи.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из “электронного газа”. Как следствие этого, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. В случае металлов невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении без нарушения связи.