Учебник по Химии.
Оглавление учебника
ОРГАНИЧЕСКАЯ ХИМИЯ
3. Алкены и циклоалкены
Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Атомы углерода, связанные двойной связью, находятся в состоянии
sp2-гибридизации, двойная связь является сочетанием s - и p -связей. Общая формула гомологического ряда алкенов СnН2n.По систематической номенклатуре названия алкенов строятся так, что в названии алкана, соответствующего этой родоначальной структуре, суффикс -ан заменяется на -ен
. В случае разветвления главной считается цепь, содержащая двойную связь, даже если эта цепь и не является самой длинной. Общее международное название этиленовых углеводородов — алкены. Непредельные углеводороды ряда этилена, содержащие одну двойную связь, называются олефинами.Углеводородные радикалы, образованные из алкенов, имеют суффикс -енил
. Некоторые радикалы имеют тривиальные названия, например, винил (этенил), аллил (пропенил).Структурная изомерия алкенов обусловлена не только строением углеродного скелета, как это свойственно алканам, но и положением двойной связи в главной углеродной цепи. Первым гомологом, для которого осуществляется изомерия с учетом этих двух признаков, является алкен
C4Н8.Пространственная изомерия
алкенов обусловлена наличием в молекуле двойной связи и различным расположением заместителей относительно плоскости p -связи. Многие алкены могут существовать в виде цис- и транс-изомеров.Физические свойства. По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов в молекуле. Низшие гомологи С2—С4 при нормальных условиях — газы, С5—С17 — жидкости, высшие гомологи — твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях.
Способы получения. Алкены являются ценным сырьем для промышленного органического синтеза. В природе они практически не встречаются, поэтому разработано много методов получения алкенов различного строения.
- Крекинг алканов.
Крекингом обычно называют процессы химических превращений органических соединений, происходящие при высокой температуре. Крекинг алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700 °С) в молекулах алканов гомолитически расщепляются s -связи С—С, при этом образуется смесь низкомолекулярных алканов и алкенов:
2. ![]()
Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними p -связи.. Атомы углерода при элиминировании переходят из sр3- в sp2-гибридное состояние. Исходными веществами могут служить представители разных классов органических соединений.
а) Дегидрогалогенирование происходит при действии спиртовых растворов щелочей на моногалогениды:![]()
В молекуле 2-бромпропана атом водорода отщепляется от любого из соседних атомов углерода, так как они равноценны. В случаях, когда соседние атомы углерода не одинаковы, отщепление атома водорода происходит преимущественно от наименее гидрогенизированного атома углерода (т. е. имеющего наименьшее число атомов водорода). Эта закономерность носит название правила Зайцева.
б) Дегидратация спиртов происходит при их нагревании с серной кислотой или пропускании паров спирта над катализатором.![]()
в) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
![]()
г) Дегидрирование алканов проводят при 500 °С в присутствии катализатора:
![]()
Химические свойства
алкенов определяются наличием в их молекулах двойной связи. Электронное облако p -связи подвергается атаке электрофильными агентами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом AE (от англ. addition electrophilic). Реакции электрофильного присоединения — это ионные процессы, протекающие в несколько стадий. Характерной особенностью электронного облака p -связи является его подвижность. Под влиянием заместителей электронная плотность p -связи может смещаться к одному из атомов углерода. p -Связь тогда становится полярной, а на атомах углерода, соединенных двойной связью, возникают частичные заряды. Увеличение полярности в конечном счете может привести к гетерологическому разрыву p -связи.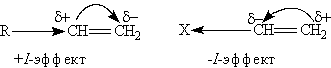
1.
Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (НСl, НВr) образуются галогеналканы, причем если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.Правило Марковникова:
при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи:![]()
2.
Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды идет по правилу Марковникова: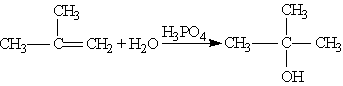
3. Галогенирование. При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь:
![]()
4.
Окисление. При окислении алкенов перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв p -связи и присоединение гидроксильной группы к каждому атому углерода, т. е. реакция гидроксидирования. В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция также является качественной на двойную связь.В связи с тем, что органические соединения при окислении образуют, наряду с основными, ряд побочных продуктов, возникают трудности в уравнивании этих реакций. Поэтому в органической химии сложилась традиция записывать эти реакции в виде схем с обозначением процесса окисления символом [О] (над стрелкой) и процесса восстановления — символом [Н].
При окислении перманганатом калия в кислой среде или хромовой смесью происходит полный разрыв двойной связи с образованием продуктов окисления. Эту реакцию называют окислительным расщеплением двойной связи.
Так, из молекулы бутена-2 в результате окислительного расщепления образуются две молекулы уксусной кислоты:
![]()
5.
Восстановление (гидрирование). Эта реакция протекает в присутствии катализатора — мелко раздробленного никеля, платины или палладия — при комнатной температуре:![]()
При гидрогенизации олефины превращаются в предельные углеводороды.
6.
Реакции полимеризации. Особым типом реакций присоединения к алкенам является их полимеризация, которая может катализироваться как электрофилами, так и радикалами или соединениями переходных металлов.Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного продукта — полимера. Молекулы алкена, вступающие в реакцию полимеризации, называются мономерами. Число элементарных звеньев, повторяющихся в макромолекуле, называется степенью полимеризации (обозначается п). В зависимости от степени полимеризации из одних и тех же мономеров можно получать вещества с различными свойствами. Так, полиэтилен с короткими цепями (
n = 20) является жидкостью, обладающей смазочными свойствами. Полиэтилен с длиной цепи в 1500-2000 звеньев представляет собой твердый, но гибкий пластический материал, из которого можно получать пленки, изготовлять бутылки и другую посуду, эластичные трубы и т. д. Наконец, полиэтилен с длиной цели в 5-6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, жесткие трубы, прочные нити.Если в реакции полимеризации принимает участие небольшое число молекул, то образуются низкомолекулярные вещества, например димеры, тримеры и т. д. Условия протекания реакций полимеризации весьма различные. В некоторых случаях необходимы катализаторы и высокое давление. Но главным фактором является строение молекулы мономера. В реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет разрыва кратных связей.
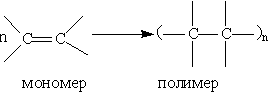
Структурные формулы полимеров кратко записывают так: формулу элементарного звена заключают в скобки и справа внизу ставят букву п. Например, структурная формула полиэтилена (—СН2—СН2—)n. Легко заключить, что название полимера слагается из названия мономера и приставки поли-, например полиэтилен, поливинилхлорид, полистирол и т. д.
Полимеризация — это цепная реакция, и, для того чтобы она началась, необходимо активировать молекулы мономера с помощью так называемых инициаторов.
Такими инициаторами реакции могут быть свободные радикалы или ионы (катионы, анионы). В зависимости от природы инициатора различают радикальный, катионный или анионный механизмы полимеризации.Наиболее распространенными полимерами углеводородной природы являются полиэтилен и полипропилен.
Полиэтилен получают полимеризацией этилена:![]()
Полипропилен получают стереоспецифической полимеризацией пропилена (пропена). Стереоспецифическая полимеризация — это процесс получения полимера со строго упорядоченным пространственным строением.
К полимеризации способны многие другие соединения — производные этилена, имеющие общую формулу СН2==СН—X, где Х — различные атомы или группы атомов.
Применение. Этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ.
Диеновые углеводороды (алкадиены). Алкадиенами называются ненасыщенные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
О наличии двух двойных связей в молекуле говорит суффикс -диен
. Для указания положения каждой двойной связи главную углеродную цепь нумеруют так, чтобы в нее входили обе двойные связи, а атомы углерода, связанные двойными связями, получили наименьшие номера. Для некоторых алкадиенов продолжают использовать тривиальные названия, например изопрен (2-метилбута-диен-1,3).Если двойные связи разделены в цепи двумя или более s -связями (пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями такие же, как и у алкенов, с той разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Если двойные связи разделены в цепи только одной s -связью, то их называют сопряженными. В этом случае в молекуле двойные и одинарные связи чередуются, как, например, в бутадиене-1,3 СН2==СН—СН==СН2, который является простейшим сопряженным алкадиеном.
Соединения с чередующимся расположением двойных связей отличаются по свойствам как от алкенов, так и от других типов алкадиенов. Особенности химического поведения этих соединений объясняются наличием сопряжения.
Сопряжение — это образование единого электронного облака в результате взаимодействия негибридизованных р-орбиталей в молекуле с чередующимися двойными и одинарными связями.
Так, в бутадиене-1,3 все четыре атома углерода находятся в состоянии sp2-гибридизации. Они лежат в одной плоскости и составляют s -скелет молекулы. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s -скелета и параллельны друг другу, что создает условия для их взаимного перекрывания. Перекрывание происходит не только между атомами С -1 —С-2, С-3—С- 4.
но и частично между атомами С-2—С-3. При перекрывании четырех р-орбиталей происходит образование единого p -электронного облака, т. е. сопряжение двух двойных связей. Этот тип сопряжения называется p
,p -сопряжением, так как взаимодействуют орбитали p -связей.В сопряженной системе p -электроны уже не принадлежат определенным связям, они делокализованы.
Делокализация электронной плотности — это ее распределение по всей сопряженной системе, по всем связям и атомам.
Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p -электронов и тем устойчивее молекула.
Способы получения. Важное промышленное значение имеет бутадиен-1,3, или дивинил, так как он является сырьем для производства синтетического каучука. Бутадиен-1,3 получают из бутановой фракции крекинг-процесса нефти. При температуре 600 °С происходит ступенчатое дегидрирование бутана над катализатором (Сr2О3, Al2О3) с образованием бутадиена-1,3: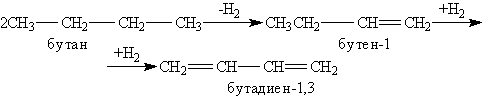
Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. С. В. Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола с катализаторами на основе ZnO и Аl2О3:
Другим важным представителем алкадиенов является 2-метилбутадиен-1,3, или изопрен![]()
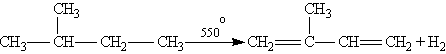
Химические свойства.
1. Для алкадиенов характерны реакции электрофилъного присоединения А
E. Однако в химическом поведении алкадиенов-1,3 есть особенности, связанные с наличием в их молекуле сопряжения. Так, в реакциях присоединения могут быть получены два продукта. Один из них получается за счет присоединения по любой двойной связи (1,2-присоединение). В этом случае алкадиен ведет себе подобно алкену. Другой продукт получается в результате 1,4-присоединения. В этом случае молекула алкадиена ведет себя как единая сопряженная система, и присоединение к ней идет как бы по ее “концам”. В получающемся продукте между атомами С-2 — С-3 содержится двойная связь.Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
2.
Полимеризация.Применение некоторых полимеров.
Поливинилхлорид — продукт полимеризации хлористого винила (винилхлорида) СН2=СНCl. Структурная формула: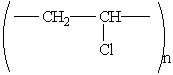
Этот полимер обладает ценными свойствами: он негорюч, устойчив к действию химических реагентов, легко окрашивается. Из пластмасс на его основе изготовляют клеенки, плащи, портфели, искусственную кожу для обуви и т. п. Широко применяется для изоляции проводов и кабелей.
Тефлон — продукт полимеризации тетрафторэтилена:
![]()
Это самое инертное органическое вещество (на него оказывают воздействие только расплавленные калий и натрий). Обладает высокой морозо- и теплоустойчивостью. Полистирол — твердое прозрачное упругое вещество. Получается полимеризацией стирола. Структурная формула:
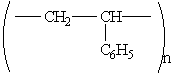
Полистирол широко используется в качестве диэлектрика в электро- и радиотехнике. Идет на изготовление кислотоупорных труб, тары, а также бытовых изделий — расчесок, игрушек и др. Из него готовят легкие пористые пластмассы — пенопласты.