Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
16. Хром
Свойства 24Cr.
|
Атомная масса |
51,99 |
кларк, ат.% (распространненость в природе) |
6×10-3 |
|
Электронная конфигурация* |
|
Агрегатное состояние (н. у.). |
твердое вещество |
|
|
0,125 |
Цвет |
серебристо-белый |
|
|
0,035 |
|
1903 |
|
Энергия ионизации
|
6,764 |
|
2642 |
|
Относительная электроотрицательность |
1,6 |
Плотность |
7,2 |
|
Возможные степени окисления |
+1 ¸ +6 |
Стандартный электродный потенциал
|
+0,29 |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе.
Хром встречается в виде соединений в различных минералах. Наиболее распространен минерал хромит, или хромистый железняк FeCr2O4, богатые месторождения которого имеются на Урале и в Казахстане. Хром обнаружен на Солнце, звездах и в метеоритах.Получение. Металлический хром получают восстановлением оксида хрома
(III) при нагревании с алюминием:![]()
Металлический хром получают также электролизом водных растворов соединений хрома.
Физические свойства. Хром — серовато-белый блестящий металл. Из металлов он самый твердый, его плотность 7,2 г/см
3, Tпл. 1855° С. Природный хром состоит из смеси пяти изотопов с массовыми числами 50, 52, 53, 54 и 56. Радиоактивные изотопы получены искусственно.Как и все d-элементы, хром
обладает рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений.Химические свойства. При высоких температурах хром горит в кислороде с образованием Сr
2O3, в раскаленном состоянии он реагирует с парами воды:![]()
при нагревании с галогенами хром образует галогениды состава С
rНаl3.В азотной и концентрированной серной кислотах хром не растворяется, так как его оксидная пленка упрочняется, т. е. хром переходит в пассивное состояние.
Хром пассивируется холодными концентрированными Н
2SO4 и HNO3. Однако при сильном нагревании эти кислоты растворяют хром: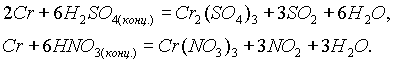
Пассивацию хрома можно устранить очисткой поверхности металла.
Хром растворяется при обычной температуре в разбавленных кислотах (НС
l, HBr, HI, H2SO4) с выделением водорода. В этих случаях в отсутствие воздуха образуются соли Сr2+, а на воздухе — соли Сr3+.При высокой температуре хром горит в кислороде, образуя оксид С
r2О3.Металлический хром при нагревании реагирует также с галогенами, галогеноводородами, серой, азотом, фосфором, углем, кремнием и бором. Например:
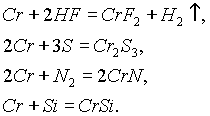
Хром образует три оксида: С
rО, Сr2O3 и СrO3.Оксид хрома (II) СrО
— пирофорный черный порошок (пирофорность — способность в тонкораздробленном состоянии воспламеняться на воздухе). Получается окислением амальгамы хрома кислородом воздуха. Растворяется в разбавленной соляной кислоте:![]()
На воздухе при нагревании выше 100° С оксид хрома (II) превращается в оксид хрома
(III).Соли хрома (
II). По своим химическим свойствам соли Cr2+ похожи на соли Fe2+. Обрабатывая их растворы щелочами в отсутствие кислорода, можно получить желтый осадок гидроксида хрома (II):![]()
который обладает типичными основными свойствами. Является восстановителем. При прокаливании
Cr(OH)2 в отсутствие кислорода образуется оксид хрома (II) СrО. При прокаливании на воздухе превращается в Сr2О3.Все соединения хрома (II) довольно неустойчивы и легко окисляются кислородом воздуха в соединения хрома
(III):![]()
Соли хрома (
III). Соли трехвалентного хрома сходны с солями алюминия по составу, строению кристаллической решетки и растворимости. В водных растворах катион Сr3+ встречается только в виде гидратированного иона [Сr(H2O)6]3+, который придает раствору фиолетовый цвет (для простоты пишут Сr3+).При действии щелочей на соли хрома (Ш) выпадает студнеобразный осадок гидроксида хрома
(III) — Сr(ОН)3 зеленого цвета:![]()
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь как в кислотах с образованием солей хрома (III)
:![]()
так и в щелочах с образованием тетрагидроксихромитов, т. е. солей, в которых Сг
3+ входит в состав аниона:![]()
В результате прокаливания Сr(ОН)
3 можно получить оксид хрома (III) Сr2О3:![]()
Оксид хрома (III) Сr
2O3 — тугоплавкий порошок зеленого цвета. По твердости близок к корунду, поэтому его вводят в состав полирующих средств. Получается соединением элементов при высокой температуре.С
r2О3 представляет собой зеленые кристаллы, практически нерастворимые в воде. Сr2О3 может быть также получен при прокаливании дихроматов калия и аммония: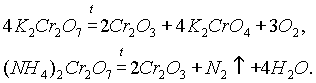
При сплавлении
Cr2O3 со щелочами, содой и кислыми солями получаются соединения Сг3+, растворимые в воде: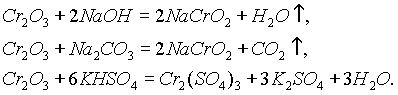
Оксид хрома (VI)
— кислотный оксид, ангидрид хромовой H2CrO4 и дихромовой H2Cr2O7 кислот.Получается при взаимодействии концентрированной серной кислоты с насыщенным раствором дихромата натрия или калия:
![]()
С
rО3 имеет кислотный характер: легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту H2CrO4:![]()
При большой концентрации С
rО3 образуется дихромовая кислота H2Cr2O7:![]()
которая при разбавлении переходит в хромовую кислоту:
![]()
Хромовые кислоты существуют только в водном растворе. Однако
, их соли весьма устойчивы.С
rО3 представляет собой ярко-красные кристаллы, легко растворимые в воде. Сильный окислитель: окисляет иод, серу, фосфор, уголь, превращаясь при этом в Cr2O3. Например:![]()
При нагревании до 250° С разлагается:
![]()
Он реагирует
со щелочами, образуя желтые хроматы СrO42- :![]()
![]()
В кислой среде ион С
rO42- превращается в ион Сr2O72- .В щелочной среде эта реакция протекает в обратном направлении:
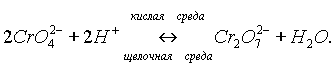
В кислой среде дихромат-ион восстанавливается до С
r3+:![]()
Если сопоставить гидроксиды хрома с разной степенью окисления
С
r2+(ОН)2, Сr3+(ОН)3 и Н2Сr6+O4, то легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные усиливаются.Сr(ОН)2 проявляет основные свойства, Сr(ОН)3 — амфотерные, а H2CrO4 — кислотные.
Хроматы и дихроматы (VI). Наиболее важными соединениями хрома в высшей степени окисления 6+ являются хромат (VI) калия К2СrО4 и дихромат (VI) калия K2Cr2O7.
Хромовые кислоты образуют два ряда солей: хроматы —
так называются соли хромовой кислоты, и дихроматы — так называются соли дихромовой кислоты. Хроматы окрашены в желтый цвет (цвет хромат-иона СrO42- ), дихроматы — в оранжевый (цвет дихромат-иона Сr2O72-).Дихроматы
Na2Cr2O7× 2Н2O и K2Cr2O7 называются хромпиками. Они как окислители применяются в кожевенной (дубление кож), лакокрасочной, спичечной и текстильной промышленности. Хромовая смесь — так называется 3%-ный раствор дихромата калия в концентрированной серной кислоте — применяется в химических лабораториях для мытья стеклянной посуды.Соли хромовых кислот в кислой среде — сильные окислители:
![]()
Соединения хрома
(III) в щелочной среде играют роль восстановителей. Под действием различных окислителей — Cl2, Br2, H2O2, КмnO4 и др. — они переходят в соединения хрома (IV) — хроматы:![]()
![]()
Здесь соединение
Cr (III) изображено в форме Na[Cr(OH)4(H2O)2], так как в виде ионов Na+ и [Cr(OH)4(H2O)2]- оно существует в избытке раствора щелочи.Сильные окислители, такие, как
KMnO4, (NH4)2S2O8 в кислой среде переводят соединения Cr (III) в дихроматы:![]()
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr
2+ ® Cr3+ ® Cr6+ . Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения крома. (III). Соединения хрома (VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения с промежуточной степенью окисления, т. е. соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями (например, бромом, KMnO4) проявлять восстановительные свойства, превращаясь в соединения хрома (VI).Соли хрома
(III) весьма разнообразны по окраске: фиолетовые, синие, зеленые, коричневые, оранжевые, красные и черные. Все хромовые кислоты и их соли, а также оксид хрома (VI) ядовиты: поражают кожу, дыхательные пути, вызывают воспаление глаз, поэтому, работая с ними, необходимо соблюдать все меры предосторожности.