Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
15. Цинк, ртуть
Свойства элементов I
I B группы.|
Свойства |
30 Zn |
48 Cd |
80 Hg |
|
Атомная масса |
65,38 |
112,40 |
200,59 |
|
Электронная конфигурация* |
|
|
|
|
|
0,139 |
0,148 |
0,150 |
|
|
0,083 |
0,103 |
0,112 |
|
Энергия ионизации
|
9,391 |
8,991 |
10,43 |
|
Относительная электроотрицательность |
1,6 |
1,7 |
1,9 |
|
Возможные степени окисления |
+2 |
+2 |
+1, +2 |
|
кларк, ат.% (распространненость в природе) |
1× 10-3 |
8× 10 -6 |
6× 10 -7 |
|
Агрегатное состояние (н. у.) |
Т В Е Р Д Ы Е В Е Щ Е С Т В А |
ЖИДКОСТЬ (20 ° С) |
|
|
Цвет |
голубовато-белый |
белый |
серебристо-белый |
|
|
419,5 |
321 |
-38,86 |
|
|
907 |
765 |
356,73 |
|
Плотность |
7,13 |
8,642 |
13,546 |
|
Стандартный электродный потенциал
|
-0,761 |
-0,402 |
+0,854 |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Получение.
В промышленности элементы II B группы получают двумя способами. Первый – пирометаллургия, в которой используются:а) окислительный обжиг:
![]() ,
,
образующийся первоначально в ходе этого процесса оксид ртути (
II) разлагается при температуре процесса по реакции:![]()
Аналогично из сульфидов цинка и кадмия получают их оксиды (
II), которые затем для получения чистых веществ подвергают восстановительному обжигу.б) восстановительный обжиг:
![]()
Второй способ
получения элементов II В группы – гидрометаллургический. Используют выщелачивание:![]()
![]()
затем электролизом раствора соли
ZnSO4 получают чистый Zn:![]()
Химические свойства элементов II B группы.
Цинк, кадмий и ртуть химически довольно инертны в атмосфере сухого воздуха. На поверхности цинка и кадмия при соприкосновении с влажным воздухом, а также содержащимся в нем СО2 образуются пленки оксидов и карбонатов.Жидкая ртуть взаимодействует при комнатной температуре с серой и иодом:
![]()
- это метод уборки ртути (иногда используют KMnO4). Пары ртути очень ядовиты!
![]()
При нагревании все элементы II В группы взаимодействуют с кислородом, серой и галогенами, проявляя в этих соединениях характерную степень окисления +2. (Оксид ртути (
II) HgO – разлагается на ртуть и кислород (см. выше)).С водой в нормальных условиях ртуть не взаимодействует, равно как цинк и кадмий, которые пассивируются вследствие наличия на поверхности оксидной пленки.
Ртуть не взаимодействует с кислотами неокислителями, а кадмий и цинк образуют с ними соли (
II) и вытесняют водород.По-разному, в зависимости от условий, реагируют эти элементы и с кислотами окислителями. Так:
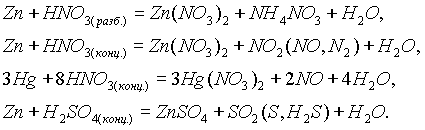
Цинк и его соединения.
Цинк в соединениях проявляет только одну степень окисления 2+. В лабораториях его часто используют для получения водорода из разбавленной соляной кислоты:![]()
Цинк взаимодействует с раствором аммиака, вытесняя из него водород:
![]()
Оксид цинка.
Оксид цинка ZnO проявляет амфотерные свойства, реагируя как с кислотами:![]()
так и с щелочами:
![]()
В последней реакции образуется анионный комплекс тетрагидроксицинката.
Гидроксид цинка. Гидроксид цинка также проявляет амфотерные свойства.
Он нерастворим в воде, но растворяется в кислотах и щелочах:![]()
![]()
При взаимодействии гидроксида цинка с раствором аммиака образуется гидроксид тетраамминцинка (как и в реакции чистого цинка с р-ром
NH3).Иначе ведет себя в этой реакции
Hg2+(гидроксид ртути (II) мгновенно разлагается на HgO и H2O):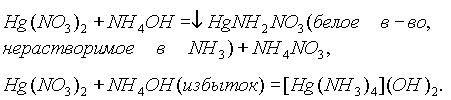
Соли цинка и ртути.
Сульфид цинка в взаимодействует с соляной кислотой:![]()
тогда как сульфид ртути растворяется только в “царской водке”:
![]()
При взаимодействии сульфида ртути с сульфидом калия образуется комплексное соединения хорошо растворимое в воде:
![]()
Пожалуй, самое известное соединение ртути –
Hg(SCN)2 – цианат, используемое для заполнения капсул детонаторов, разлагающееся с эффектным образованием “фараоновых змей”: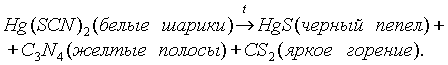
Еще одно известное соединение ртути –
HgCl2 – сильный яд! Хотя в медицине и применяется как анитсептик. При взаимодействии сулемы с аммиаком образуется аминосоединение, которое используется в медицине для приготовления мазей:![]()
![]()
При взаимодействии сулемы с ртутью образуется еще одно ядовитое соединение ртути – каломель
Hg2Cl2:![]() .
.
В этом соединении присутствуют связи ¾
Hg ¾ Hg ¾ .Каломель выделяется и при разложении аминосоединения ртути, образующегося по вышеприведенной реакции:
![]()
При взаимодействии каломели с хлором образуется хлорид ртути (
II), а в реакции в хлоридом олова (II), выделяется ртуть:![]()