Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
14. Медь, серебро
Свойства элементов I
B группы.|
Свойства |
29 Cu |
47 Ag |
79 Au |
|
Атомная масса |
63,546 |
107,868 |
196,966 |
|
Электронная конфигурация* |
|
|
|
|
|
0,127 |
0,144 |
0,144 |
|
|
0,098 |
0,113 |
0,137 |
|
Энергия ионизации
|
7,726 |
7,547 |
9,223 |
|
Относительная электроотрицательность |
1,9 |
1,9 |
2,4 |
|
Возможные степени окисления |
+1, +2, +3 |
+1, +2, +3 |
+1, +3 |
|
кларк, ат.% (распространненость в природе) |
0,003 |
2× 10- 6 |
5× 10- 8 |
|
Агрегатное состояние (н. у.) |
Т В Е Р Д Ы Е В Е Щ Е С Т В А |
||
|
Цвет |
красный |
белый |
желтый |
|
|
1083 |
961,3 |
1064,7 |
|
|
2593 |
2180 |
2707 |
|
Плотность |
8,96 |
10,50 |
19,3 |
|
Стандартный электродный потенциал
|
0,51 |
0,81 |
1,68 |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Медь. Физические свойства.
Медь — довольно мягкий металл красно-желтого цвета. Ее атомы имеют электронную конфигурацию внешнего уровня 3d104s1.Химические свойства.
Медь обладает наименьшей активностью среди всех переходных металлов. Так, она не реагирует с разбавленными соляной и серной кислотами. Она растворяется только в кислотах-окислителях: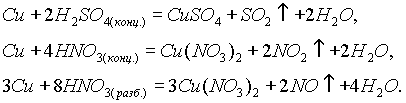
В соединениях медь проявляет две степени окисления: 1+ и 2+, из которых более устойчиво состояние 2+.
Одновалентная медь встречается либо в нерастворимых соединениях (CuCl, Cu2S), либо в виде растворимых комплексов типа [Cu(NH3)2]+.Хлорид меди (I)
растворяется в концентрированном растворе аммиака с образованием комплексного иона диамминмеди (I) [Cu(NH3)2]+:![]()
Так же в аммиаке растворяется оксид меди
(I) Cu2O:![]()
Ионы Си
2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Cu(H2O)6]2+, имеющих характерную сине-голубую окраску. При добавлении гидроксида натрия к раствору, содержащему эти ионы, образуется голубой осадок гидратированного гидроксида меди (II):![]()
Полученный осадок, в свою очередь, растворяется в растворе аммиака, образуя ярко-синий комплекс:
![]()
Изменение окраски соединений меди при переходе из степени окисления 2+ в степень окисления 1+ используется в органической химии для качественного анализа. Так, свежеосажденный гидроксид Си(ОН)
2 синего цвета восстанавливается до оранжевого осадка Сu2О альдегидами или восстанавливающими углеводами, например глюкозой.Серебро. Химические свойства.
Серебро, так же как и медь, не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах-окислителях: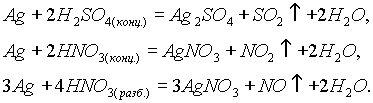
В большинстве соединений серебро проявляет степень окисления 1+.
Растворимый нитрат серебра используется как реактив для качественного определения ионов Сl- , Вr- , I- :![]()
При добавлении
NaOH к раствору AgNO3 образуется темно-коричневый осадок оксида серебра Ag2O:![]()
Подобно соединениям меди (I), осадки
AgCl и Ag2O могут растворяться в растворах аммиака с образованием комплексных соединений: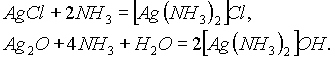
Последний комплекс используется в органической химии в качественной реакции на альдегиды (реакция “серебряного зеркала”).