Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
12. Щелочноземельные металлы, бериллий, магний
Свойства элементов II A группы.
|
Свойства |
4 Be |
12 Mg |
20 Ca |
38 Sr |
56 Ba |
88 Ra |
|
Атомная масса |
9,012 |
24,305 |
40,80 |
87,62 |
137,34 |
226,025 |
|
Электронная конфигурация* |
|
|
|
|
|
|
|
|
0,113 |
0,160 |
0,190 |
0,213 |
0,225 |
0,235 |
|
|
0,034 |
0,078 |
0,106 |
0,127 |
0,133 |
0,144 |
|
Энергия ионизации
|
9,32 |
7,644 |
6,111 |
5,692 |
5,21 |
5,28 |
|
Относительная электро- |
1,5 |
1,2 |
1,0 |
1,0 |
0,9 |
0,9 |
|
Возможные степени окисления |
+2 |
+2 |
+2 |
+2 |
+2 |
+2 |
|
кларк, ат.% (распро- |
1*10-3 |
1,4 |
1,5 |
8*10-3 |
5*10-3 |
8*10-12 |
|
Агрегатное состояние (н. у.). |
Т В Е Р Д Ы Е В Е Щ Е С Т В А |
|||||
|
Цвет |
Серо- |
Сереб- |
С Е Р Е Б Р И С Т О – Б Е Л Ы Й |
|||
|
|
1283 |
649,5 |
850 |
770 |
710 |
700 |
|
|
2970 |
1120 |
1487 |
1367 |
1637 |
1140 |
|
Плотность |
1,86 |
1,741 |
1,540 |
2,67 |
3,67 |
6 |
|
Стандартный электродный потенциал
|
-1,73 |
-2,34 |
-2,83 |
-2,87 |
-2,92 |
- |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Как следует из данных, приведенных в таблице, элементы IIA группы имеют низкие (но все же не самые низкие: сравни с IA гр.) величины энергии ионизации и относительной электроотрицательности, при чем эти величины уменьшаются от Be к Ba, что позволяет сделать вывод о том, что эти элементы – типичные металлы-восстановители, и Ba – более активен, чем Be.
Ве – проявляет, подобно алюминию, амфотерные свойства. Однако у Ве металлические свойства все же более ярко выражены, чем неметаллические. Бериллий реагирует в отличие от остальных элементов IIA группы со щелочами.
Химические связи в соединениях Ве в основном ковалентные, тогда как связи в соединениях всех остальные элементов (Mg - Ra) носят ионный характер. При этом, как и у элементов IA группы, связи с галогенами и кислородом весьма прочные, а с водородом, углеродом, азотом, фосфором и серой – легко гидролизуются.
Физические свойства. Это металлы серебристо-белого цвета, относительно легкие, мягкие (за исключением бериллия), пластичные, легкоплавкие (все, кроме бериллия), обладают хорошей электро- и теплопроводностью.
Практическое применение. Ве используется в атомной технике как замедлитель и поглотитель нейтронов. Сплавы бериллия с медью – бронзы – очень стойкие, а с никелем – обладают высокой химической устойчивостью, благодаря чему и используются в хирургии.
Mg, Ca – используются как хорошие восстановители в металлотермии.
Ca, Sr, Ba – достаточно легко реагируют с газами и используются как геттеры (поглотители из воздушной среды) в вакуумной технике.
Получение. Будучи высоко химически активными, щелочноземельные металлы не встречаются в природе в свободном состоянии, их получают электролизом расплавов галогенидов или металлотермией. В природе щелочноземельные элементы входят в состав следующих минералов:
Химические свойства.
Щелочноземельные металлы легко реагируют с кислородом, галогенами, неметаллами, водой и кислотами, особенно при нагревании:![]()
![]()
![]()
![]()
Получить соединения Be и Mg с водородом прямым взаимодействием простых веществ не удалось:
![]()
Металлы IIA группы по-разному взаимодействуют с водой:
![]()
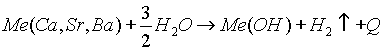
Взаимодействие с кислотами не окислителями
:Взаимодействие с кислотами окислителями
:![]()
продукты взаимодействий остальных металлов с кислотами-окислителями зависят от условий их протекания, так: ![]() , а при взаимодействии Mg с концентрированной азотной кислотой возможно образование помимо нитрата магния также
, а при взаимодействии Mg с концентрированной азотной кислотой возможно образование помимо нитрата магния также![]() и др.
и др.
Взаимодействие с основаниями: ![]() реакция не идет, т. к. эти металлы сильные восстановители;
реакция не идет, т. к. эти металлы сильные восстановители;
![]() - проявление амфотерности бериллия;
- проявление амфотерности бериллия;
![]()
Оксиды щелочноземельных металлов.
Оксиды щелочноземельных элементов находят широкое применение в строительстве. Их получают разложением солей:В ряду оксидов от BeO до BaO слева направо растет растворимость оксидов в воде, их основные свойства и химическая активность, так: BeO – нерастворим в воде, амфотерен, MgO – мало растворим в воде, а CaO, SrO, BaO – хорошо растворяются в воде с образованием гидроксидов Me(OH):
Температуры плавления оксидов понижаются в ряду BeO ® BaO. Температуры плавления оксидов BeO и MgO »
2500 ° C, что позволяет использовать их как огнеупорные материалы.Гидроксиды щелочноземельных металлов. В ряду Be(OH)
2 ® Ba(OH)2 растет радиус ионов Ме2+, и, как следствие, увеличивается вероятность проявления основных свойств гидроксидов, их растворимость в воде: Ве(ОН)2 – мало растворим в воде, вследствие своей амфотерности проявляет слабые кислотные и основные свойства, а Ва(ОН)2 – хорошо растворим в воде и по своей силе может сравнится с таким сильным основанием как NaOH.Амфотерность гидроксида бериллия можно проиллюстрировать следующими реакциями:
![]()
![]()
Соли щелочноземельных металлов. Растворимые соли Be и Ba – токсичны, ядовиты!
СaF2 – малорастворимая соль, встречается в природе как флюорит или плавиковый шпат, находит применение в оптике. СaCl2, MgCl2 – хорошо растворимы в воде, находят применение в медицине и химическом синтезе в качестве осушителей. Карбонаты также находят широкое применение в строительстве: СaCО3Ч MgCО3 – доломит – используется в строительстве и для получения Vg и Ca. СaCО3 – кальцит, мел, мрамор, исландский шпат, MgCО3 – магнезит. Содержание растворимых карбонатов в природной воде определяет ее жесткость: