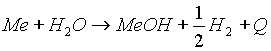Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
11. Щелочные металлы
Свойства элементов I A группы.
Свойства |
3 Li |
11 Na |
19 K |
37 Rb |
55 Cs |
87 Fr |
|
Атомная масса |
6,941 |
22,9898 |
39,098 |
85,468 |
132,905 |
[223] |
|
Электронная конфигурация* |
|
|
|
|
|
|
|
|
0,155 |
0,189 |
0,238 |
0,253 |
0,274 |
0,280 |
|
|
0,068 |
0,098 |
0,133 |
0,149 |
0,165 |
0,175 |
|
Энергия ионизации
|
5,392 |
5,14 |
4,341 |
4,176 |
3,89 |
3,98 |
|
Относительная электро- |
0,97 |
1,01 |
0,91 |
0,89 |
0,86 |
0,86 |
|
Возможные степени окисления |
+1 |
+1 |
+1 |
+1 |
+1 |
+1 |
|
кларк, ат.% (распро- |
0,02 |
2,0 |
1,1 |
7*10-3 |
9*10-9 |
- |
|
Агрегатное состояние (н. у.), цвет |
С Е Р Е Б Р И С Т Ы Е М Е Т А Л Л Ы |
|||||
|
|
180,05 |
97,82 |
63,2 |
38,7 |
28,64 |
23 |
|
|
1317 |
890 |
753,8 |
701 |
635 |
669 |
|
Плотность |
0,534 |
0,971 |
0,862 |
1,532 |
1,873 |
2,1- 2,4 |
|
Стандартный электродный потенциал
|
-3,02 |
-2,71 |
-2,92 |
-2,925 |
-2,91 |
- |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Как видно из данных, приведенных в таблице, элементы IA обладают большими атомными радиусами (самыми большими в периоде) и низкой энергией ионизации (самой низкой в периоде), при этом в группе энергия ионизации уменьшается сверху вниз, так что Cs обладает наименьшей энергией ионизации вообще. Аналогичные выводы можно сделать и исходя из значений относительной электроотрицательности. В силу выше названных причин, химические связи в соединениях щелочных металлов – ионные.
Физические свойства. Элементы IA группы – типичные металлы. В силу относительной легкости протекания процесса ионизации, они - сильные восстановители, особенно Rb и Cs, что позволяет широко использовать их в фотоэлементах.
Это металлы, серебристого цвета (у Cs иногда встречается розовато-желтоватый оттенок), мягкие, пластичные, легкоплавкие, легколетучие. Обладают хорошей тепло- и электропроводностью.
Уменьшение температуры плавления от Li к Cs объясняется увеличением размера атома (см. табл.) и, как следствие, ослаблением межатомных связей.
Практическое применение. Na используется как восстановитель в металлотермии. Li и Na также применяются при изготовлении сталей, в качестве т. наз. “раскислителей”, которые удаляют примеси из стали (O
2, N2 , S, As и др.).Получение. Из-за высокой химической активности щелочные металлы встречаются в природе только в виде соединений (галогенидов, нитратов силикатов и др.). Чистые металлы получают путем электролиза расплавов галогенидов и щелочей или металлотермией.
Химические свойства. Как уже было сказано, элементы IA группы – сильные восстановители, активные металлы (Ме). Они легко реагируют с водой, кислотами. другими металлами и неметаллами, особенно при нагревании: