Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
5. Азот
Свойства 7N.
|
Атомная масса |
14,006 |
кларк, ат.% (распространненость в природе) |
0,03 |
|
Электронная конфигурация* |
|
Агрегатное состояние (н. у.). |
газ |
|
|
0,071 |
Цвет |
бесцветный |
|
|
0,015 |
|
-210,01 |
|
Энергия ионизации
|
14,53 |
|
-195,81 |
|
Относительная электро- |
3,0 |
Плотность |
0,879 |
|
Возможные степени окисления |
-3 ¸ +5 |
Стандартный электродный потенциал
|
¾ |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе.
Азот в природе встречается главным образом в свободном состоянии. В воздухе объемная доля его составляет 78,09%, а массовая доля 75,6%. Соединения азота в небольших количествах содержатся в почвах. Азот входит в состав белковых веществ и многих естественных органических соединений.Получение. В технике азот получают из жидкого воздуха. Как известно, воздух — это смесь газов, главным образом азота и кислорода. Сухой воздух у поверхности Земли содержит (в объемных долях): азота 78,09%, кислорода 20,95%, благородных газов 0,93%, оксида углерода (IV) 0,03%, а также случайные примеси — пыль, микроорганизмы, сероводород, оксид серы (IV) и др. Для получения азота воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (т. кип. азота -195,8° С, кислорода -183° С). Полученный таким образом азот содержит примеси благородных газов (преимущественно аргона). Чистый азот можно получить в лабораторных условиях, разлагая при нагревании нитрит аммония:
![]()
Физические свойства. Азот в свободном состоянии — газ без цвета и запаха, состоящий из двухатомных молекул
N2. Он является основным компонентом атмосферы Земли (78% по объему). Азот легче воздуха. Растворимость в воде меньше, чем у кислорода: при 20 °С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота.Природный азот состоит из двух стабильных изотопов с массовыми числами 14 (99,64%) и 15 (0,36%).
В молекуле
N2 атомы связаны тремя ковалентными связями (две p -связи, одна s -связь), поэтому энергия диссоциации этой молекулы чрезвычайно велика:![]()
Этим объясняется малая реакционная способность азота при обычной температуре (сравните с О
2 и Cl2).Химические свойства. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул нагреванием, облучением или другими способами.
Из металлов азот реагирует в обычных условиях только с литием, образуя нитрид:
![]()
С другими металлами он реагирует лишь при высоких температурах, образуя нитриды. С натрием, кальцием и магнием реакция идет только при нагревании:
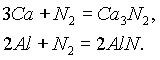
Образующиеся нитриды полностью гидролизуются при контакте с водой:
![]()
С кислородом азот взаимодействует только в электрической дуге
(3000-4000° С) (например, при грозовом разряде в атмосфере) или при очень сильном нагревании:![]()
Поскольку на внешнем энергетическом уровне атома азота находится 5 электронов, азот проявляет степени окисления -3 и +5, а также +4, +3, +2, +1, -1 и -2.
Применение. В больших количествах азот употребляется для получения аммиака. Широко используется для создания инертной среды — наполнение электрических ламп накаливания и свободного пространства в ртутных термометрах, при перекачке горючих жидкостей. Им азотируют поверхность стальных изделий, т. е. насыщают их поверхность азотом при высокой температуре. В результате в поверхностном слое образуются
нитриды железа, которые придают стали большую твердость. Такая сталь выдерживает нагревание до 500 °С без потери своей твердости.Важное значение азот имеет для жизни растений и животных, поскольку он входит в состав белковых веществ. Соединения азота находят применение в производстве минеральных удобрений, взрывчатых веществ и во многих отраслях промышленности.
Аммиак. В огромных количествах азот используется для синтеза аммиака.
Реакция с водородом идет при нагревании (хотя процесс и экзотермический
!) и очень высоком давлении и обязательно с катализатором:![]()
Физические свойства.
Аммиак — важнейшее соединение азота. В обычных условиях это — бесцветный газ, легче воздуха, с резким запахом. Аммиак сжижается при -33,35 °С и затвердевает при -77,7 °С.Молекула аммиака имеет форму пирамиды, в основании которой лежит треугольник из атомов водорода, а в вершине — атом азота, в жидком аммиаке молекулы NH3 связаны между собой водородными связями, обусловливая тем самым аномально высокую температуру кипения. Полярные молекулы NH3 очень хорошо растворимы в воде (700 объемов NH3 в одном объеме H2O).
Электронная формула молекулы аммиака такова:
![]()
Видно, что из четырех электронных пар при азоте три общие (связывающие) и одна неподеленная (несвязывающая).
Химическая связь N—Н полярная: положительный заряд сосредоточен на атомах водорода, отрицательный — на атоме азота. Вследствие этого между молекулами аммиака и образуется водородная связь, что можно изобразить так:
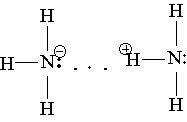
Благодаря водородным связям аммиак имеет сравнительно высокие температуры плавления и кипения, а также высокую теплоту испарения, он легко сжижается.
Раствор аммиака в воде представляет собой раствор гидроксида аммония, содержащий одновременно молекулярные частицы
NH3 и NH4OH и ионы NH4+ и ОН- :![]()
Водный раствор аммиака обладает свойствами слабого основания, константа его диссоциации при 25 °С составляет 1,8
Ч 10-5.Азот в аммиаке имеет наименьшую степень окисления и поэтому проявляет только восстановительные свойства. Так, например, при горении аммиака образуются азот и вода:
![]()
В присутствии катализатора аммиак может окисляться и до оксида азота NО:
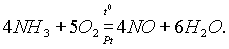
При нагревании аммиака с галогенами, перок
cидом водорода, оксидами тяжелых металлов образуется молекулярный азот: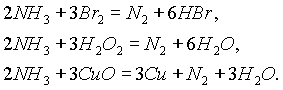
Аммиак идет главным образом на производство азотной кислоты и различных удобрений — нитрата аммония
NH4NO3, карбамида (мочевины) (NH2)2CO, аммофоса (смесь гидро- и дигидрофосфатов аммония (NH4)2HPO4 и NH4H2PO4).Соли аммония.
Продукты взаимодействия аммиака с кислотами представляют собой соли аммония:![]()
Соли аммония по многим свойствам похожи на соли щелочных металлов, особенно на соли калия и рубидия. Такое сходство объясняется
тем, что размер иона аммония (радиус 1,48 А) близок к размерам ионов К+ (1,33 Å) и Rb+ (1,48 Å).Они проявляют общие свойства солей, т. е. взаимодействуют с растворами щелочей, кислот и других солей:
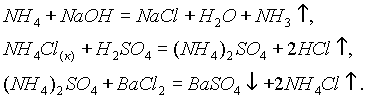
Все
аммонийные соли растворимы в воде и при этом гидролизуются. Соли аммония термически неустойчивы и при нагревании разлагаются: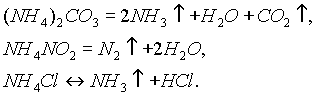
![]()
Оксиды азота.
В оксидах азота степень его окисления меняется от 1+ до 5+. Оксиды N2O и NO—- бесцветные газы, оксид азота (IV) NO2 — бурый газ, получивший в промышленности название “лисий хвост”. Оксид азота (III) N2O3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы.Оксиды N
2O и NO не реагируют c водой и щелочами, тогда как N2O3 и N2O5, являясь ангидридами, при взаимодействии с водой дают соответствующие кислоты: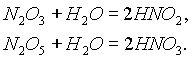
Азотистая кислота.
HNO2 неустойчива, тогда как ее соли нитриты, устойчивы.Оксид азота (IV)
NO2 легко подвергается димеризации, уже при незначительном охлаждении образуя жидкость желто-зеленого цвета:![]()
Оксид азота
NO2 при растворении в воде обратимо диспропорционирует:![]()
Поскольку образующаяся азотистая кислота неустойчива, то при нагревании реакция идет по-другому:
![]()
Если диоксид азота
NO2 растворяют в воде в присутствии кислорода, то получают только азотную кислоту:![]()
Последнюю реакцию используют в промышленности для получения азотной кислоты.
Азотная кислота
. НNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, очень гигроскопична, “дымит” на воздухе. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.Химические свойства.
Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет:![]()
Азотная кислота принадлежит к числу наиболее сильных кислот, и для нее характерны все реакции, в которые вступают кислоты, — с основаниями, основными оксидами и т. д.
Специфическим свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион
NO3- , имеющий в своем составе азот в степени окисления 5+, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- в связи с этим может протекать до различных веществ: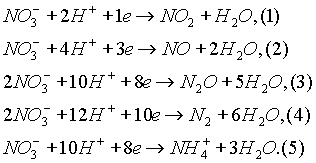
Какое из этих веществ образуется, т. е. насколько глубоко произошло восстановление азотной кислоты, в каждом конкретном случае зависит от природы восстановителя, от условий протекания реакции и от концентрации самой кислоты.
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее
HNO3, тем менее глубоко она восстанавливается.С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме
(1) с выделением NO2; если HNO3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2—5), в зависимости от степени разбавления.Чтобы восстановление HN
O3 провести наиболее глубоко, необходимо использовать максимально разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоде. При использовании более концентрированной кислоты низшие оксиды азота (образованные в ходе реакции) окисляются концентрированной кислотой до высших.Азотная кислота взаимодействует со всеми металлами, за исключением
Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.Большинство неметаллов и сложных веществ восстанавливают HN
O3, как правило, до NO (реже до NO2):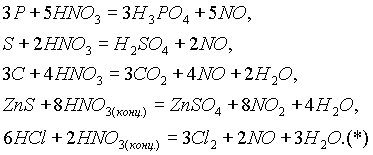
Азотная кислота окисляет при нагревании даже
кремний:![]()
Однако полного растворения образца кремния при этом не происходит, так как, едва начавшись, последняя реакция быстро прекращается, поскольку образующийся на поверхности кристаллический
SiO2 (кислотный оксид с высшей степенью окисления кремния) препятствует дальнейшему протеканию реакции.Если же взять смесь азотной и плавиковой кислот, то при нагревании происходит полное растворение образца кремния:
![]()
С помощью концентрированной
HNO3 можно растворить также и золото. Для этого необходимо взять смесь, состоящую из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):![]()
Действие царской водки объясняется тем, что концентрированная HN
O3 окисляет НСl по реакции (*) до свободного хлора, который в момент выделения является очень сильным окислителем. По этой причине при растворении металлов в царской водке никогда не получаются соли азотной кислоты, а получаются соответствующие хлориды.Разложение нитратов. При нагревании твердых нитратов практически все они разлагаются с выделением кислорода (единственным исключением является нитрат аммония), при этом все нитраты можно разделить на четыре группы.
Первую группу составляют нитраты
щелочных металлов, которые при нагревании разлагаются на нитриты и кислород, например:![]()
Вторую группу
составляет большинство нитратов менее активных металлов (от щелочноземельных металлов до меди включительно), которые разлагаются на оксид металла, NO2 и кислород:![]()
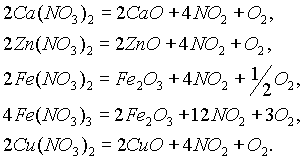
Третью группу
составляют нитраты наиболее тяжелых металлов, разлагающиеся до свободного металла, NO2 и кислорода: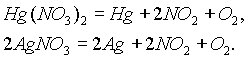
Четвертую группу
составляет нитрат аммония.![]()
Азотистая кислота. HNО
2 принадлежит к слабым кислотам (К = 6Ч10-4 при 25 °С), она лишь немного сильнее уксусной. Азотистая кислота неустойчива и известна только в разбавленных растворах, в которых осуществляется равновесие![]()
Нитриты, в отличие от самой кислоты, устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду:
![]()
Применение.
Большие количества азотной кислоты расходуются на приготовление азотных удобрений, взрывчатых и лекарственных веществ, красителей пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.