Учебник по Химии.
Оглавление учебника
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
1. Водород
Свойства 1H.
Атомная масса |
1,008 |
кларк, ат.% (распространненость в природе) |
17 |
Электронная конфигурация* |
|
Агрегатное состояние (н. у.). |
газ |
|
¾ |
Цвет |
бесцветный |
|
0,136 |
|
- 259,1 |
Энергия ионизации
|
13,6 |
|
- 252,6 |
Относительная электроотрицательность |
2,10 |
Плотность |
¾ |
Возможные степени окисления |
+1, |
Стандартный электродный потенциал
|
0 |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Атом водорода состоит из одного протона и одного электрона. Этот простейший атом не имеет аналогов в периодической системе. Он способен терять электрон, превращаясь в катион Н
+, и в этом отношении сходен со щелочными металлами, которые также проявляют степень окисления 1+. Атом водорода может также присоединять электрон, образуя при этом анион Н- , электронная конфигурация которого такая же, как у атома гелия. В этом отношении водород сходен с галогенами, анионы которых имеют электронные конфигурации соседних благородных газов.Таким образом, водород имеет двойственную природу, проявляя как окислительную, так и восстановительную способность. По этой причине в одних случаях водород помещают в подгруппу щелочных металлов, в других — в подгруппу галогенов.
Химические свойства. Энергия связи в молекуле водорода
H2 составляет 436 кДж/моль. Большая величина энергии связи объясняет сравнительно малую активность молекулярного водорода при обычных условиях. Так, при комнатной температуре водород реагирует лишь с фтором:![]()
и с хлором при ультрафиолетовом облучении.
При повышенной температуре водород реагирует со многими веществами: он сгорает в атмосфере кислорода с образованием воды и выделением большого количества теплоты:
![]()
Соединения водорода с неметаллами.
При нагревании водород обратимо реагирует также с бромом, иодом, серой и азотом, причем с последним только в присутствии катализатора и при высоком давлении.Водород при нагревании способен реагировать не только с простыми, но и со сложными веществами:
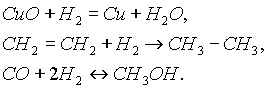
Во всех рассматриваемых реакциях водород является восстановителем, образуя соединения, где его степень окисления равна 1+.
Соединения водорода с металлами. Со многими металлами водород вступает в реакции при повышенных температуре и давлении с образованием гидридов
(NaH, KH, СаН2, где его степень окисления равна 1-:![]()
Гидрид натрия — белое кристаллическое соединение, по физическим свойствам напоминающее хлорид натрия. Однако химические свойства NaH и
NaCI сильно различаются. Так, хлорид натрия растворяется в воде и диссоциирует в растворе на ионы. Гидрид натрия водой разлагается с образованием щелочи и водорода:![]()
Получение.
Для промышленного получения водорода используют следующие способы:1. Электролиз водных растворов хлоридов.
2. Пропускание паров воды над раскаленным углем при температуре 1000 °С:
![]()
3. Конверсия метана при высоких температурах:
![]()
4. Крекинг углеводородов.
Для лабораторного получения водорода используют следующие способы:
1. Взаимодействие металлов с кислотами:
![]()
2. Взаимодействие щелочноземельных металлов
с водой:![]()
3. Взаимодействие алюминия или кремния с водными растворами щелочей:
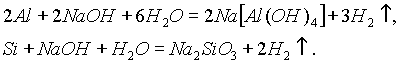
4. Взаимодействие гидридов с водой.
Вода. Оксид водорода — одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, — она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
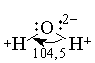
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н
2О содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)х, благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств; максимальная плотность при 4° С, высокая температура кипения (в ряду Н2О—H2S — H2Se — Н2Те), аномально высокая теплоемкость [4,18 кДж/(гЧ К)]. С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.Химические свойства. Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочноземельными металлами:
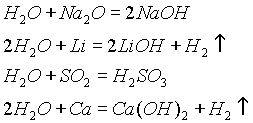
Вода образует многочисленные соединения — гидраты (кристаллогидраты
):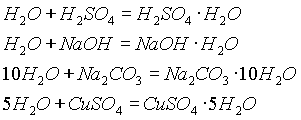
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р
2O5, СаО, ВаО, металлический Na (они тоже химически взаимодействуют с водой), а также силикагель.К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения.
Тяжелая вода
. Вода, содержащая тяжелый водород, называется тяжелой водой (обозначается формулой D2O). Как это видно из сопоставления физических свойств, она отличается от обычной воды:(в скобках приведены характеристики обычной воды (H2O))Молекулярная масса: 20 (18)
Плотность при 20
°С, г/см3 : 1,1050 (0,9982)Температура кристаллизации
, oC: 3,8 (0)Температура кипения, °С:
101,4 (100)Химические реакции с тяжелой водой протекают значительно медленнее, чем с обычной водой. Поэтому она при длительном электролизе обычной воды накапливается в электролизере.
Тяжелая вода применяется в качестве замедлителей нейтронов в ядерных реакторах.